香港科技大學(科大)發現了哺乳類動物中調控音猬因子(Shh)分泌的機制,加強了解這個能影響癌症進程的重要信號因子,為研發相關癌症的治療方案提供新的思路。
音猬因子參與調節生物體生長發育中的多個關鍵環節,包括細胞增殖和分化、胚胎發育、體節形成、組織內穩態平衡及再生等。Shh信號通路相關突變及缺陷會導致癌症的發生,Shh在癌細胞的生長和遷移中也起著關鍵作用。目前所有的Shh 信號通路抑制劑都針對於 Shh 與目標細胞表面受體結合之後的下游通路中的蛋白。然而,這些抑制劑對於治療配體依賴型的癌症效果並不顯著。
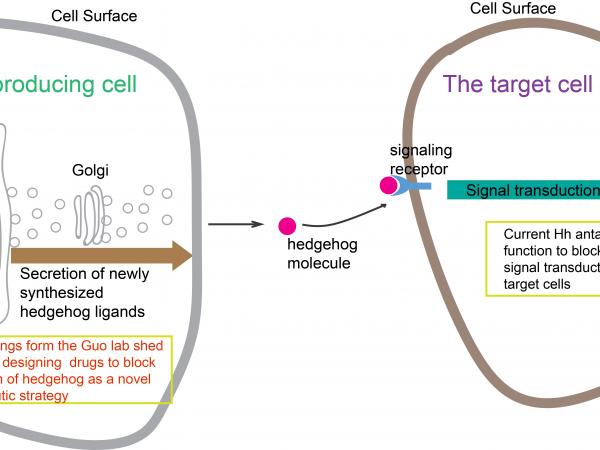
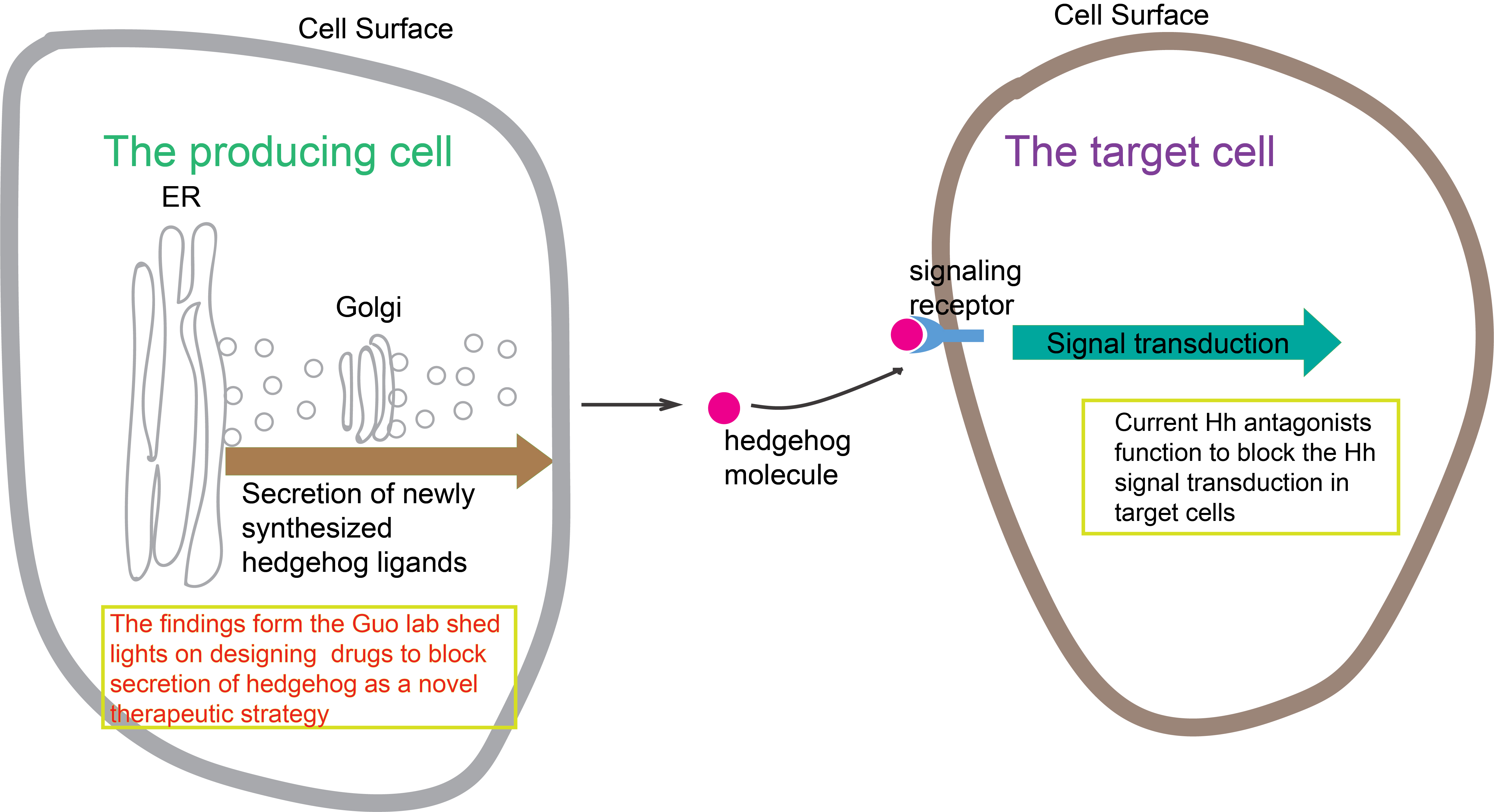
新合成的Shh沿著分泌轉運途徑被傳遞至質膜釋放到細胞外基質後,被靶細胞表面受體識別,從而激活下游信號通路。由科大生命科學學部副教授郭玉松領導的研究發現,貨物受體蛋白SURF4和蛋白多糖以接力的方式調控Shh從內質網到高爾基體的運輸,為Shh的合成轉運途徑的分子機制提供新的見解,並且為設計Shh 信號通路抑制劑治療癌症提供新的方案。
可溶性貨物蛋白比如胰島素和音猬因子在核糖體合成出來後,必須通過分泌轉運途徑分泌到細胞外基質才能夠行使其生理功能。儘管這個過程非常重要,但是其分子機制大部分未為科學家所知。分析這一至關重要的細胞過程的兩個主要障礙是:使用傳統的實驗方法很難直接定量分析將貨物蛋白質包裝到運輸囊泡中的效率;這些可溶性貨物蛋白一旦被細胞合成後就被細胞分泌出去,因此在常態下很難對這些可溶性貨物蛋白的運輸做精準的細胞內部定位分析。
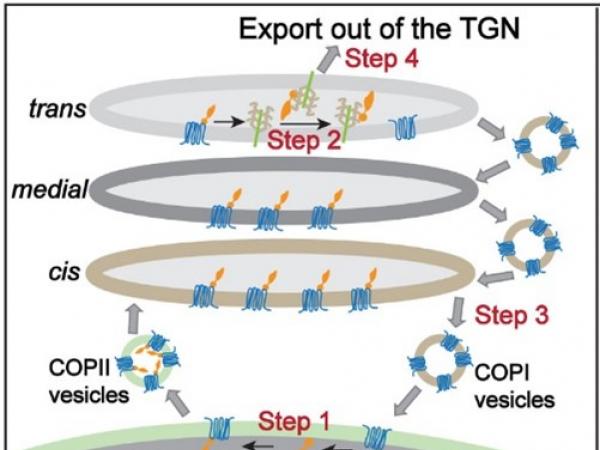
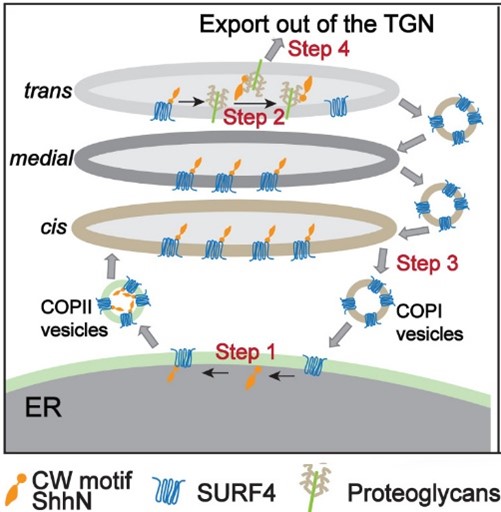
為了克服這些問題,團隊通過體外囊泡重組法重構了音猬因子在分泌途徑中被篩選入運輸囊泡的過程,並採用高效同步化的蛋白運輸系統(RUSH轉運法)使得音猬因子從內質網的同步化輸出受控於生物素的調控(錄像1)。通過這些獨特的方法以及其他的細胞分子生物學手段,研究闡明了Shh的胞內轉運通過以下幾個步驟調控:
- 貨物受體SURF4通過直接結合Shh的CW基序將其包裝入COPII囊泡(圖一A,步驟1)。
- 到達高爾基體後,蛋白多糖與 SURF4 競爭結合 Shh促使SURF4與Shh 解離(圖一A,步驟2)。
- 被釋放的SURF4通過COPI囊泡回到內質網(圖一A,步驟3)。
- 蛋白多糖和Shh的CW基序結合,將其從高爾基體運輸出去(圖一A,步驟4)。
該研究為Shh分泌轉運途徑的分子機制提供了新的見解,SURF4-蛋白多糖的接力機制也為細胞生物學中一個重要問題提供了新思路:貨物受體如何捕獲它們的貨物,然後在目的地與貨物脫離?
郭教授說:「該研究也將為未來合理設計阻礙Shh運輸的抑制劑提供有效的知識基礎,有助研發基於抑制Shh介導的信號通路來治療相關癌症的創新方案。」
研究成果最近於《美國國家科學院院刊》發表,團隊同時已提交美國臨時專利申請。
郭教授為本研究的通訊作者,MRC分子生物學實驗室的Elizabeth A. Miller教授、科大的姚舒懷教授及黃晉卿教授、香港城市大學的張亮教授,以及中國科學院的胡俊杰教授參與了該項研究。科大博士後研究員唐笑是這項研究的第一作者。