香港科技大學(科大)的研究人員發現了幹細胞微環境如何控制幹細胞分化為各種功能性細胞,這對於未來利用幹細胞治療各種人類疾病具有重要意義。
人體幹細胞擁有獨特的能力,可以複製和分化為特定的組織細胞,從而支持人體正常發育和維持組織功能運作。基於這種特性,幹細胞具有潛力將受損或患病的細胞替換為健康的細胞,用於治療柏金遜症、阿爾茲海默症及1 型糖尿病等疾病。
雖然幹細胞具有治療人類疾病的潛力,但開發幹細胞療法並不簡單。其中一個挑戰在於如何有效地將幹細胞分化為具有不同功能的細胞,以替換退化組織中的受損細胞。幹細胞周圍的組織(即幹細胞微環境)對幹細胞分化成功能性細胞起著控制作用,但科學家對其中的分子機制了解有限,這使得這一任務更加困難。
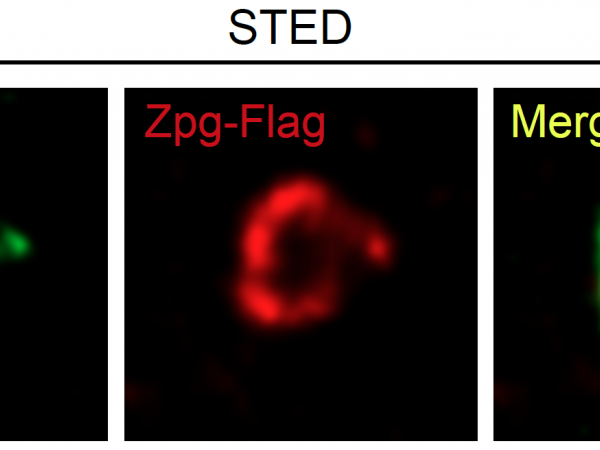
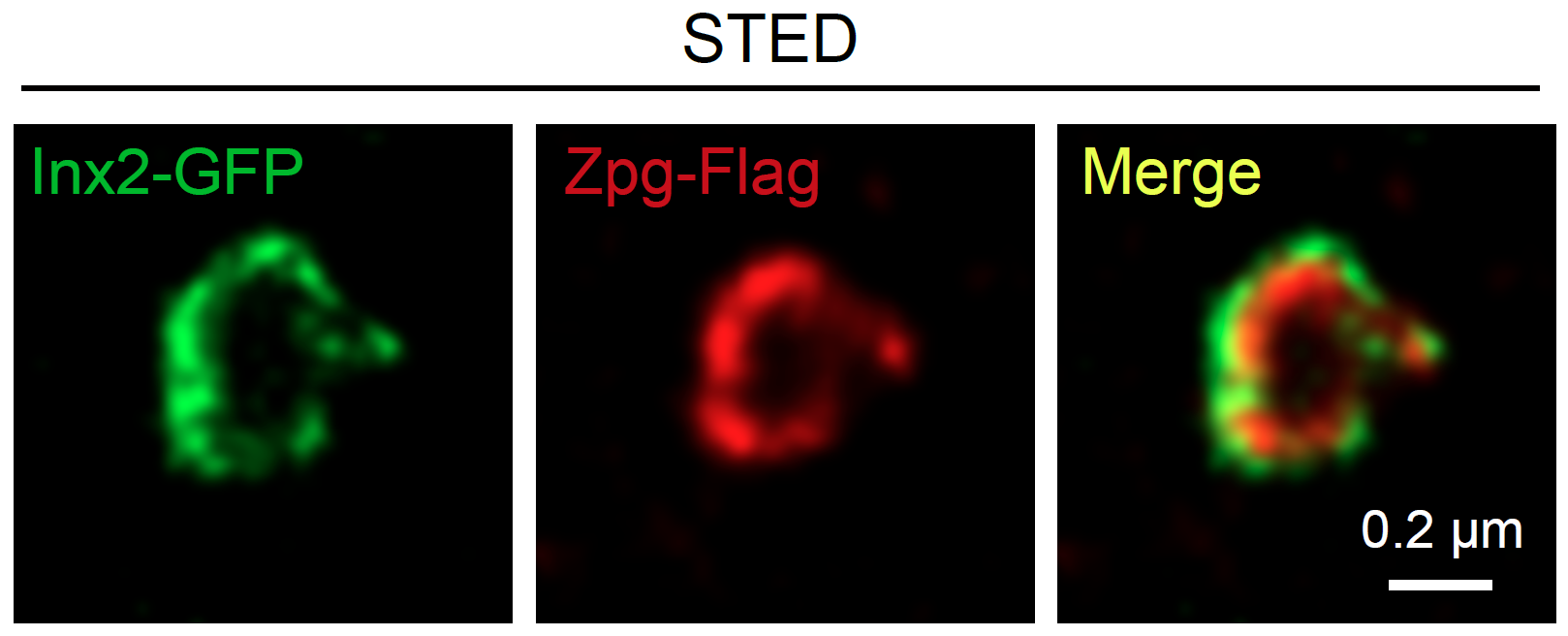
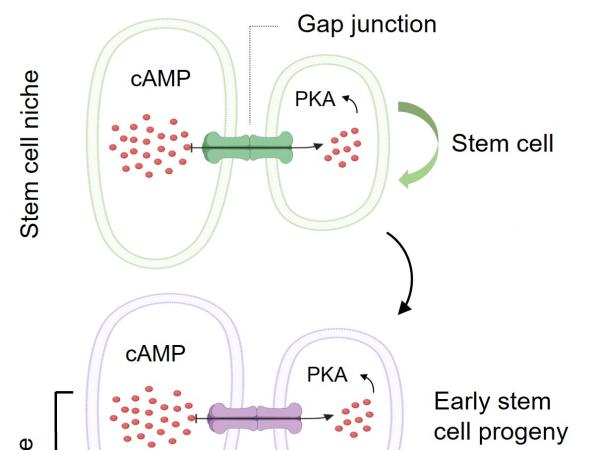
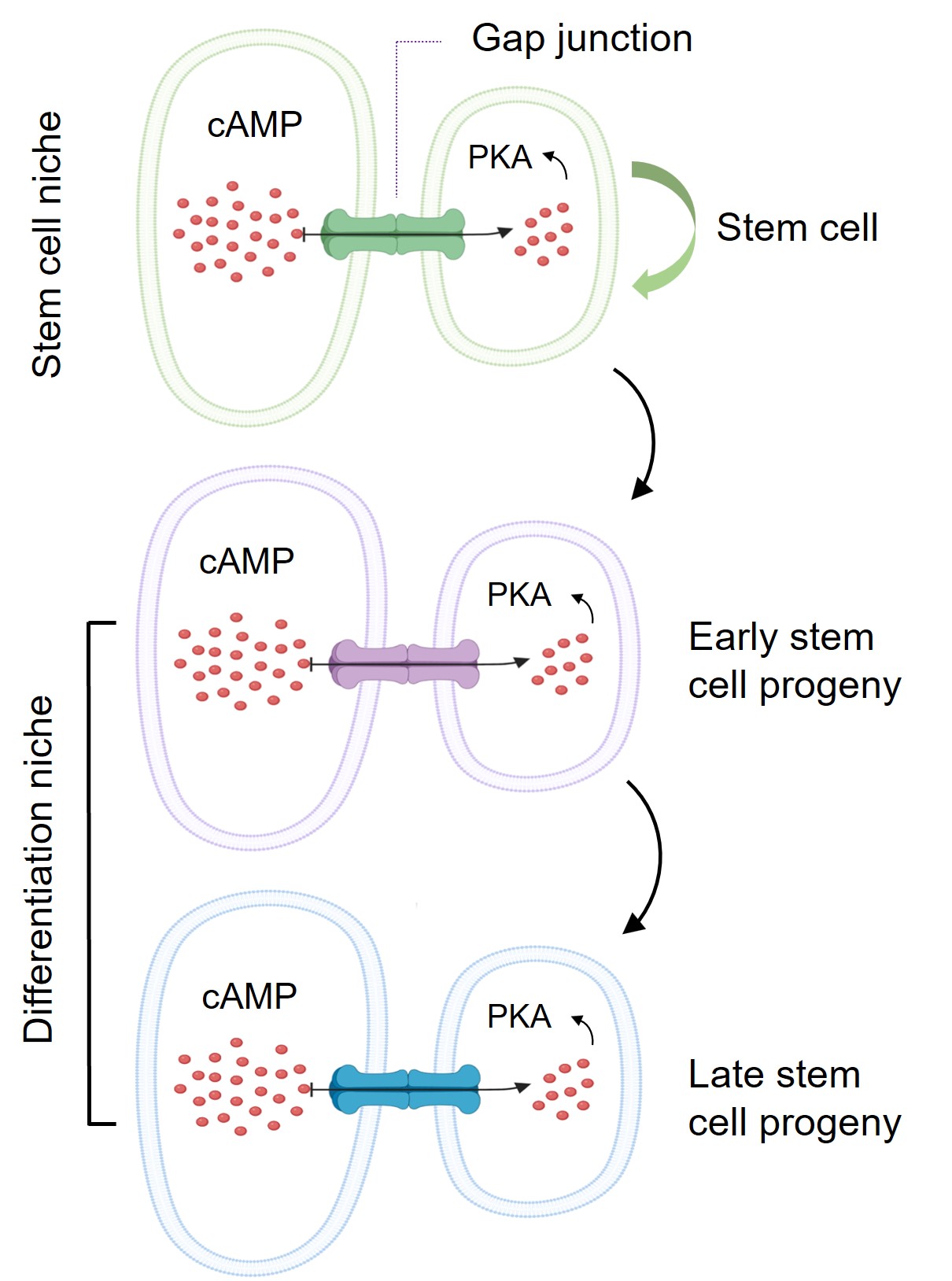
近日,科大生命科學部主任及講座教授解亭所帶領的團隊首次發現,幹細胞微環境利用一種稱為「間隙連接」(Gap junction)的蛋白通道,將幹細胞微環境內的第二信使(Secondary messenger)cAMP傳送到幹細胞及其子代細胞,以控制其分化過程。作為細胞內最重要的第二信使,cAMP負責調節多個細胞功能,包括幹細胞的分化。
本身亦為嘉里理學教授的解教授選擇果蠅卵巢作為實驗模型,研究了兩種幹細胞微環境如何分別控制幹細胞自我復修和分化過程。
透過了解幹細胞微環境的調節機制,有助我們引導幹細胞分化為適當的細胞類型,以移植到已退化的人體組織。另外,退化性疾病一般會破壞幹細胞微環境和幹細胞,因此了解幹細胞微環境的調節機制也有助於重建幹細胞微環境,以移植並幫助幹細胞分化為功能性細胞。
解教授表示:「這些發現推動了幹細胞生物學和再生醫學的知識前沿,為將來應用幹細胞治療各種人類疾病奠定了基礎。未來,我們將會研究人類幹細胞微環境是否同樣利用「間隙連接」(Gap junction)傳送cAMP,以控制幹細胞分化為功能性細胞,進一步進行修復。除此以外,我們還會嘗試從幹細胞微環境中,揭示其他經「間隙連接」通道傳送至幹細胞及其子代細胞的分子。」
有關研究是由科大及美國斯托爾斯醫學研究所(Stowers Institute for Medical Research)的研究人員合作完成,最近於國際學術期刊《美國國家科學院院刊》(Proceedings of the National Academy of Sciences)上發表。研究團隊包括科大生命科學部研究助理教授屠仁軍博士及本科生湯笑寒和徐蕤,此外還包括斯托爾斯醫學研究所的平兆華博士和餘祖林博士。